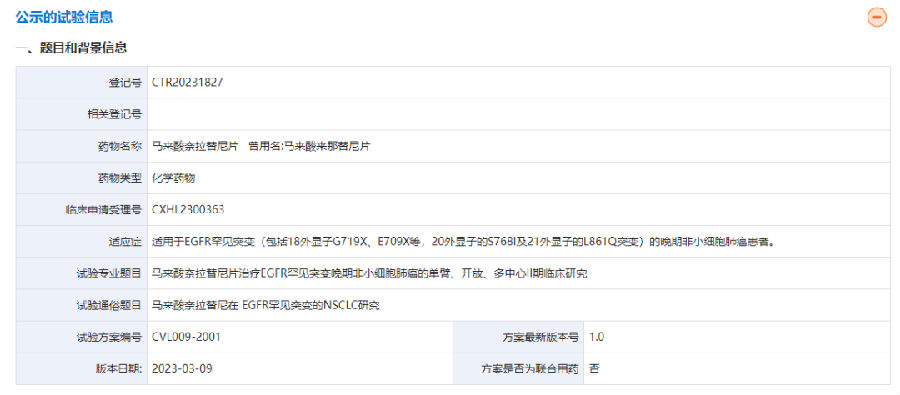
近日,甫康藥業(yè)CVL009片治療EGFR罕見突變晚期非小細(xì)胞肺癌的單臂、開放、多中心臨床研究項目啟動會順利舉行,標(biāo)志著公司CVL009項目正式進(jìn)入臨床實施階段。甫康藥業(yè)臨床運(yùn)營團(tuán)隊在吳子愛副總裁領(lǐng)導(dǎo)下,一直期盼著該項目盡早啟動,大家提前做足準(zhǔn)備,爭分奪秒,有條不紊地開展各項工作:3月30日提交IND申請,6月12日獲得臨床批件,在短短2個月內(nèi)獲得全國8家知名三甲腫瘤醫(yī)院肺癌教授們的大力支持,6月獲得中心倫理批件并且完成了數(shù)十家供應(yīng)商合作伙伴的簽約,非常高效地完成了各項準(zhǔn)備工作,為即將到來的臨床試驗患者順利入組打下了堅實的基礎(chǔ)。
甫康藥業(yè)CEO沈孝坤博士表示中國肺癌患者基數(shù)龐大,肺癌罕見基因突變患者的臨床需求不容忽視。目前國內(nèi)EGFR罕見突變晚期非小細(xì)胞肺癌還沒有靶向治療藥物獲批上市,患者亟需更好的治療方案。CVL009片一旦獲批上市將為中國EGFR罕見突變晚期非小細(xì)胞肺癌患者提供療效好、可負(fù)擔(dān)的治療選擇,希望大家共同努力早日完成臨床試驗和注冊上市工作。臨床運(yùn)營副總裁吳子愛女士在致辭中表示:一個高質(zhì)量的注冊臨床試驗順利完成需要團(tuán)隊高效協(xié)作,我們將共同應(yīng)對挑戰(zhàn),實現(xiàn)預(yù)定目標(biāo)。本項目成功上市將會為晚期肺癌患者帶來最先進(jìn)的治療方案,也將改變中國患者治療指南。啟動會上高級醫(yī)學(xué)經(jīng)理王瓊和項目經(jīng)理王東分別介紹了臨床研究方案設(shè)計和項目管理工作計劃。通過本次會議,大家明確了各自的任務(wù)和職責(zé),團(tuán)隊成員建立了完善的項目管理會議機(jī)制,明確了研究時間表。大家一起對研究過程中可能遇到的潛在困難進(jìn)行了充分的分析和討論,紛紛表示要竭盡全力,保質(zhì)保量完成任務(wù)。
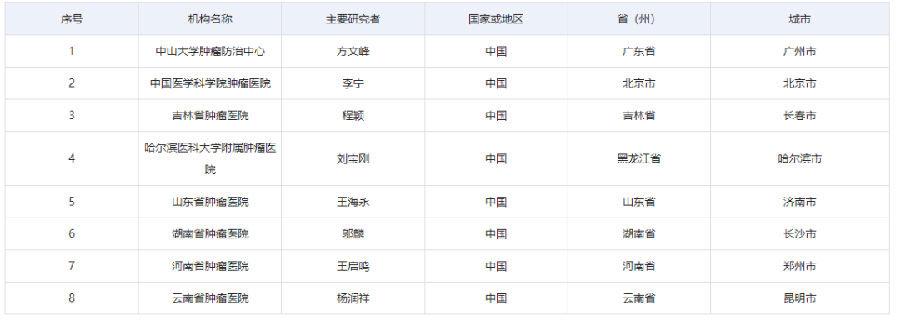
該項目在全國8家知名醫(yī)院研究中心同步開展: